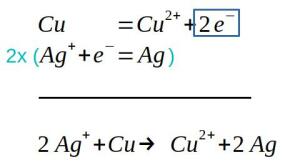Suivi et modélisation de l'évolution d'un système chimique, exemple de l'oxydo-réduction
Savoirs
Transformation modélisée par une réaction d'oxydo-réduction : oxydant, réducteur, couple oxydant-réducteur, demi-équation électronique.
Savoir-faire
À partir de données expérimentales, identifier le transfert d'électrons entre deux réactifs et le modéliser par des demi-équations électroniques et par une réaction d'oxydo-réduction. Établir une équation de la réaction entre un oxydant et un réducteur, les couples oxydant-réducteur étant donnés. Mettre en œuvre des transformations modélisées par des réactions d'oxydo-réduction.
Qu'est ce qu'une réaction d'oxydo réduction ?
Vocabulaire
Une réaction d'oxydo-réduction[1] est un transfert d'électrons entre deux couples oxydant[2]-réducteur[3]. Elle s'accompagne de deux réactions simultanées , une oxydation[4] et une réduction[5].
Pour modéliser un réaction d'oxydo-réduction, il faut :
Connaître les deux couples oxydant/réducteur[6] mis en jeux
Savoir écrire la demi-équation électronique pour chaque couple
Disposer d'un descriptif ou d'un visuel de la réaction permettant par le raisonnement de déterminer quel est l'oxydant et quel est le réducteur (produits / réactifs).
Savoir ensuite écrire l'équation bilan illustrant la réaction , les électrons n'existent pas en solution, il faut pouvoir additionner les deux demi-équations sans que des électrons apparaissent dans le bilan.
Illustration par l'exemple
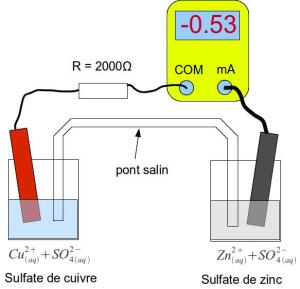
La pile Cuivre Zinc
C'est l'exemple le plus classique , les couples mis en jeux sont :
pour l'élément cuivre : Cu2+/Cu et pour l'élément zinc Zn2+ / Zn
Une observation détaillée de ce montage permet d'observer que :
L'ampèremètre indique une valeur négative, donc le courant entre par la borne COM, on en déduit que des électrons arrivent sur la lame de cuivre et quittent la lame de zinc.
La solution contenant la lame de cuivre contient également des ions cuivre Cu2+.
La solution contenant la lame de zinc contient également des ions zinc Zn 2+.
En temps réel, on verrait un dépôt de cuivre se former sur la lame de cuivre
On verrait également la lame de zinc se
"décomposer"petit à petit.
On déroule ensuite son savoir :
Pour le couple Cu2+/Cu, la demi-équation est Cu2+ + 2e- = Cu
Pour le couple Zn2+ / Zn, la demi-équation électronique est Zn2+ + 2e- = Zn
D'après les observations, au niveau de la lame de cuivre, il se forme du cuivre donc on passe de Cu2+ à Cu. , on connaît donc le sens de la réaction Cu2+ + 2e- -> Cu, on parle ici d'une réduction[5].
Donc dans l'autre couple, il doit y avoir oxydation[4], Zn -> Zn2+ + 2 e- , comme le confirme l'affirmation il y a décomposition de la lame de cuivre .
On en déduit :